Правило гессе: ПРАВИЛО ГЕССЕ | это… Что такое ПРАВИЛО ГЕССЕ?
Какое главное правило мудрого человека? — По мнению Германа Гессе | МУДРОСТЬ ВЕКОВ
Умный человек старается идти своей собственной дорогой, даже если его путь не совпадает с тем, по которому его отправляют ближние. Да, прислушиваться к советам нужно, иногда даже необходимо, но если у человека нет собственного мнения, жить чужим- не лучший вариант.
Человек, который отдает себя делу, интересен и самому себе, и окружающим. В нем есть сила, помогающая осуществить желаемое. Наше счастье и успешность в жизни зависят от мотивации, целей, которые мы ставим перед собой.
Только мы сами являемся хозяевами своей жизни, и только от нас зависит, какой она будет.
По настоящему мудрый человек не станет осуждать другого, пытаться вмешиваться в чужую жизнь, особенно если его об этом не просят. Если у него попросят совета, он непременно даст его, но бесцеремонно вмешиваться- не его конек.
Обладая самоиронией и чувством юмора, он подскажет, как достойно выйти из любого положения. Такой человек может и беззлобно подшутить, а где необходимо, ответить с достоинством.
Такой человек может и беззлобно подшутить, а где необходимо, ответить с достоинством.
Всем нам с детства известно золотое правило: “К тебе относятся так, как ты сам к себе относишься”. Поэтому очень важно ценить себя, не позволять другим унижать и оскорблять, стараться сохранять достоинство в любых ситуациях. Только неудачники считают, что изменить ничего невозможно, судьба от них отвернулась, и лично они ни в чем не виноваты и поделать уже ничего не могут.
В противовес им, человек, стремящийся к успеху, ищет все новые пути и возможности достижения всевозможных благ. Тем более, что окружающие словно считывают нашу неуверенность или, наоборот, решительность.
Некоторые люди ошибочно полагают, что не способны многого в жизни добиться и это совершенно зря. Если быть убежденным всем сердцем и разумом, что все непременно поучится, удача обязательно повернется лицом.
Любому человеку свойственно ошибаться, даже самому умному. Никто не застрахован от неприятностей, жизненных сложностей и проблем в отношении с окружающими. Но если решиться на изменение всей жизни к лучшему, нужно прежде всего начать действовать, работать в позитивном и созидательном направлении.
Но если решиться на изменение всей жизни к лучшему, нужно прежде всего начать действовать, работать в позитивном и созидательном направлении.
И тогда уже, мысля и действуя по-новому, вы с удивлением обнаружите, что оказывается, все было не так уж и сложно. Если будут ошибки, насмешки- это не беда, а лишь дополнительный опыт, за приобретение которого тоже можно поблагодарить судьбу.
Поэтому и не стоит вмешиваться в чужие жизни, чтобы потом не оказаться виноватыми, пусть это будет личный выбор и ошибка конкретного человека, за которые он потом и расплатиться. В ваших силах помочь сомневающемуся, но все-таки, он должен идти своим путем.
Знаменитый немецкий писатель и художник Герман Гессе, рассуждая о правилах жизни по-настоящему мудрого человека , выразился очень точно:
Тем самым классик, лауреат Нобелевской премии, подчеркнул важность принятия собственного решения непосредственно самим человеком, без оглядки на мнение других. Иногда даже эгоизм, но разумеется, в разумных пределах, может сослужить хорошую службу.
Поделиться в социальных сетях
Вам может понравиться
Правило Гессе
Телефонуйте:
Youtube Video 🙂
Вікіпедія
Серпень 21, 2021
Правило Гессе — правило, згідно з яким особини популяцій в північних районах мають відносно більшу масу серця в порівнянні з особинами південних місць існування. Це й зрозуміло — велика інтенсивність обміну і необхідність підтримувати відносно постійну температуру тіла при більш низьких температурах вимагає кращого кровопостачання. А для цього потрібний більш потужний серцевий м’яз.
Є як би доповненням до правила Бергмана, яке свідчить — при просуванні на північ середні розміри тіла в популяціях ендотермних тварин збільшуються.
Зміст
- 1 Див. також
- 2 Література
- 3 Ресурси Інтернету
- 4 Виноски
Див. також
- Правило Бергмана
Література
- Быков Б.
 А. Экологический словарь. — Алма-Ата: Наука, 1983. — 216 с.
А. Экологический словарь. — Алма-Ата: Наука, 1983. — 216 с. - Дедю И. И. Экологический энциклопедический словарь. — Кишинев, 1989.
- Словарь ботанических терминов / под общ. ред. И. А. Дудки. — Киев : Наукова думка, 1984. — 308 с. (рос.)
Ресурси Інтернету
- Дедю И. И. Экологический энциклопедический словарь. — Кишинев, 1989
- Словарь ботанических терминов / Под общ. ред. И. А. Дудки. — Киев, Наук. Думка, 1984
- Англо-русский биологический словарь (online версия)
- Англо-русский научный словарь (online версия)
Виноски
Правило, Гессе, правило, згідно, яким, особини, популяцій, північних, районах, мають, відносно, більшу, масу, серця, порівнянні, особинами, південних, місць, існування, Це, зрозуміло, велика, інтенсивність, обміну, необхідність, підтримувати, відносно, постійн. Pravilo Gesse pravilo zgidno z yakim osobini populyacij v pivnichnih rajonah mayut vidnosno bilshu masu sercya v porivnyanni z osobinami pivdennih misc isnuvannya Ce j zrozumilo velika intensivnist obminu i neobhidnist pidtrimuvati vidnosno postijnu temperaturu tila pri bilsh nizkih temperaturah vimagaye krashogo krovopostachannya A dlya cogo potribnij bilsh potuzhnij sercevij m yaz Ye yak bi dopovnennyam do pravila Bergmana yake svidchit pri prosuvanni na pivnich seredni rozmiri tila v populyaciyah endotermnih tvarin zbilshuyutsya Zmist 1 Div takozh 2 Literatura 3 Resursi Internetu 4 VinoskiDiv takozh RedaguvatiPravilo BergmanaLiteratura RedaguvatiBykov B A Ekologicheskij slovar Alma Ata Nauka 1983 216 s Dedyu I I Ekologicheskij enciklopedicheskij slovar Kishinev 1989 Slovar botanicheskih terminov pod obsh red I A Dudki Kiev Naukova dumka 1984 308 s ros Resursi Internetu RedaguvatiDedyu I I Ekologicheskij enciklopedicheskij slovar Kishinev 1989 Slovar botanicheskih terminov Pod obsh red I A Dudki Kiev Nauk Dumka 1984 Anglo russkij biologicheskij slovar online versiya Anglo russkij nauchnyj slovar online versiya Vinoski RedaguvatiOtrimano z https uk wikipedia org w index php title Pravilo Gesse amp oldid 29812154, Вікіпедія, Українська, Україна, книга, книги, бібліотека, стаття,
читати
, завантажити, безкоштовно, безкоштовно завантажити, mp3, відео, mp4, 3gp, jpg, jpeg, gif, png, малюнок, музика, пісня, фільм, книга, гра, ігриЗакон Гесса — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1964
Закон суммирования постоянной теплоты Гесса (или просто Закон Гесса ) гласит, что независимо от множества стадий или стадий реакции полное изменение энтальпии реакции равно сумме всех изменений.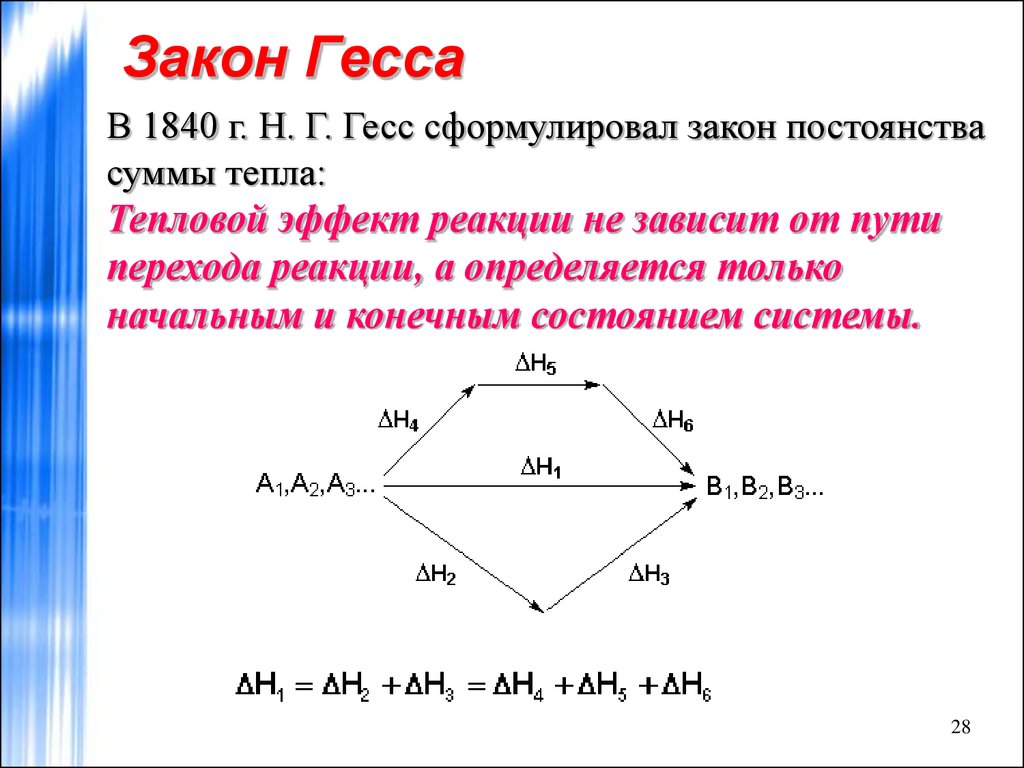 Этот закон является проявлением того, что энтальпия является функцией состояния.
Этот закон является проявлением того, что энтальпия является функцией состояния.
Введение
Закон Гесса назван в честь русского химика и доктора Жермена Гесса. Гесс помог сформулировать первые принципы термохимии. Его самая известная статья, опубликованная в 1840 году, включала его закон о термохимии. Закон Гесса связан с тем, что энтальпия является функцией состояния, что позволяет нам рассчитать общее изменение энтальпии, просто суммируя изменения на каждом этапе пути, пока не образуется продукт. Все этапы должны проходить при одинаковой температуре, и уравнения для отдельных этапов должны быть сбалансированы. Принцип, лежащий в основе закона Гесса, применим не только к энтальпии, но и может использоваться для расчета других функций состояния, таких как изменения энергии Гиббса и энтропии. 9°_f}\) для конкретной реакции равна сумме теплот реакции для любого набора реакций, которые в сумме эквивалентны общей реакции:
(Хотя мы не рассмотрели ограничение, применимость этого закона требует что все рассматриваемые реакции протекают в одинаковых условиях: мы будем считать, что все реакции происходят при постоянном давлении. )
)
Заявка
Газообразный водород, представляющий потенциальный интерес на национальном уровне в качестве чистого топлива, может быть получен в результате реакции углерода (угля ) и вода:
\[C_{(s)} + 2 H_2O_{(g)} \rightarrow CO_{2\, (g)} + 2 H_{2\, (g)} \tag{2}\]
Калориметрия показывает, что эта реакция требует ввода 90,1 кДж тепла на каждый моль потребляемого \(C_{(s)}\). По соглашению, когда теплота поглощается во время реакции, мы считаем количество теплоты положительным числом: с химической точки зрения \(q > 0\) для эндотермической реакции. При выделении тепла реакция является экзотермической и по соглашению \(q < 0\).
Интересно спросить, куда уходит эта входная энергия, когда происходит реакция. Один из способов ответить на этот вопрос — рассмотреть тот факт, что реакция превращает одно топливо, \(C_{(s)}\), в другое, \(H_{2(g)}\). Чтобы сравнить энергию, доступную в каждом топливе, мы можем измерить теплоту, выделяющуюся при сгорании каждого топлива с одним молем газообразного кислорода. Заметим, что
Заметим, что
\[C_{(s)}+O_{2(g)} \rightarrow CO_{2(g)} \tag{3}\]
дает \(393,5\, кДж\) на один моль углерода сгорел; отсюда \(q=-393,5\, кДж\). Реакция
\[2 H_{2(г)} + O_{2(г)} \rightarrow 2 H_2O_{(г)} \tag{4}\]
дает 483,6 кДж на два моля сожженного газообразного водорода. , поэтому q=-483,6 кДж. Очевидно, что при сжигании водородного топлива можно получить больше энергии, чем при сжигании углеродного топлива, поэтому неудивительно, что преобразование углеродного топлива в водородное требует затрат энергии. Очень важно отметить, что тепловложение в уравнении [2], 90,1 кДж, в точности равна разнице между теплотой, выделяющейся —393,5 кДж при сгорании углерода, и теплотой, выделяющейся —483,6 кДж при сгорании водорода. Это не случайно: если взять горение углерода и добавить к нему обратную горение водорода, то получится
\[C_{(s)}+O_{2(g)} \rightarrow CO_{2 (g)}\]
\[2 H_2O_{(g)} \rightarrow 2 H_{2(g)} + O_{2(g)}\]
\[C_{(s)} + O_{ 2(г)} + 2 H_2O_{(г)} \rightarrow CO_{2(г)} + 2 H_{2(г)} + O_{2(г)} \tag{5}\]
Если исключить \(O_{2(g)}\) с обеих сторон, поскольку он не является ни реагентом, ни продуктом, уравнение [5] эквивалентно уравнению [2]. Таким образом, если взять горение углерода и «вычесть» горение водорода (точнее, добавить обратное горение водорода), то получится уравнение [2]. А теплота сгорания углерода за вычетом теплоты сгорания водорода равна теплоте уравнения [2]. Изучая таким образом многие химические реакции, мы обнаруживаем, что этот результат, известный как закон Гесса, является общим.
Таким образом, если взять горение углерода и «вычесть» горение водорода (точнее, добавить обратное горение водорода), то получится уравнение [2]. А теплота сгорания углерода за вычетом теплоты сгорания водорода равна теплоте уравнения [2]. Изучая таким образом многие химические реакции, мы обнаруживаем, что этот результат, известный как закон Гесса, является общим.
Почему это работает
Наглядный пример применения закона Гесса к теплоте уравнения [2] является иллюстративным. На рисунке 1 реагенты C(s) + 2 H 2 O(g) помещены вместе в коробку, представляющую состояние материалов, участвующих в реакции, до реакции. Продукты CO 2 (г) + 2 H 2 (г) помещены вместе во второй ящик, представляющий состояние материалов, вовлеченных в реакцию после реакции. Стрелка реакции, соединяющая эти прямоугольники, помечена теплотой этой реакции. Теперь мы берем те же материалы и помещаем их в третью коробку, содержащую C(s), O 2 (г) и 2 H 2 (г). Этот блок соединен с блоками реагентов и продуктов стрелками реакции, помеченными теплотой реакции в уравнении [3] и уравнении [4].
Этот блок соединен с блоками реагентов и продуктов стрелками реакции, помеченными теплотой реакции в уравнении [3] и уравнении [4].
Эта картина закона Гесса показывает, что теплота реакции по «пути», непосредственно соединяющей состояние реагента с состоянием продукта, в точности равна общей теплоте реакции по альтернативному «пути», соединяющему реагенты с продуктами через промежуточное состояние, содержащее \(C_{(s)}\), \(O_{2(g)}\) и 2 \(H_{2(g)}\). Следовательно, следствием нашего наблюдения закона Гесса является то, что чистое тепло, выделяющееся или поглощаемое во время реакции, не зависит от пути, соединяющего реагент с продуктом (это утверждение опять-таки зависит от нашего ограничения, согласно которому все реакции в альтернативном пути должны протекать при постоянной температуре). условия давления).
Несколько иной вид на рис. 1 получается, если начать с ящика с реагентами и проследить полный цикл через другие ящики, ведущие обратно к ящику с реагентами, суммируя чистое тепло реакции по мере продвижения. Мы обнаруживаем, что чистое переданное тепло (опять же при условии, что все реакции происходят при постоянном давлении) точно равно нулю. Это утверждение о сохранении энергии: энергия в состоянии реагента не зависит от процессов, вызвавших это состояние. Следовательно, мы не можем извлекать энергию из реагентов с помощью процесса, который просто воссоздает реагенты. Если бы это было не так, мы могли бы бесконечно производить неограниченное количество энергии, следуя окольным путем, постоянно воспроизводящим исходные реагенты.
Мы обнаруживаем, что чистое переданное тепло (опять же при условии, что все реакции происходят при постоянном давлении) точно равно нулю. Это утверждение о сохранении энергии: энергия в состоянии реагента не зависит от процессов, вызвавших это состояние. Следовательно, мы не можем извлекать энергию из реагентов с помощью процесса, который просто воссоздает реагенты. Если бы это было не так, мы могли бы бесконечно производить неограниченное количество энергии, следуя окольным путем, постоянно воспроизводящим исходные реагенты.
Рассуждая таким образом, мы можем определить функцию энергии, значение которой для реагентов не зависит от того, как было приготовлено состояние реагента. Точно так же значение этой энергетической функции в состоянии продукта не зависит от способа приготовления продукта. Мы выбираем эту функцию H так, чтобы изменение функции ΔH = H продуктов — H реагентов было равно теплоте реакции q в условиях постоянного давления. Н, которую мы называем энтальпией, является функцией состояния, так как ее значение зависит только от состояния рассматриваемых материалов, то есть от температуры, давления и состава этих материалов.
Концепция функции состояния несколько аналогична идее возвышения. Учитывайте разницу высот между первым и третьим этажами здания. Эта разница не зависит от пути, который мы выбираем для перехода с первого этажа на третий. Мы можем просто подняться на два лестничных пролета, или мы можем подняться на один лестничный пролет, пройти вдоль здания, а затем пройти второй лестничный пролет. Или мы можем поехать на лифте. Мы могли бы даже выйти на улицу, и кран поднял бы нас на крышу здания, откуда мы спускаемся на третий этаж. Каждый путь дает точно такой же прирост высоты, даже если пройденное расстояние значительно отличается от одного пути к другому. Это просто потому, что высота является «функцией состояния». Наше возвышение, стоящее на третьем этаже, не зависит от того, как мы попали на третий этаж, и то же самое относится и к первому этажу. Поскольку высота, таким образом, является функцией состояния, прирост высоты не зависит от пути. Теперь существование функции энергетического состояния H имеет большое значение при расчете теплоты реакции.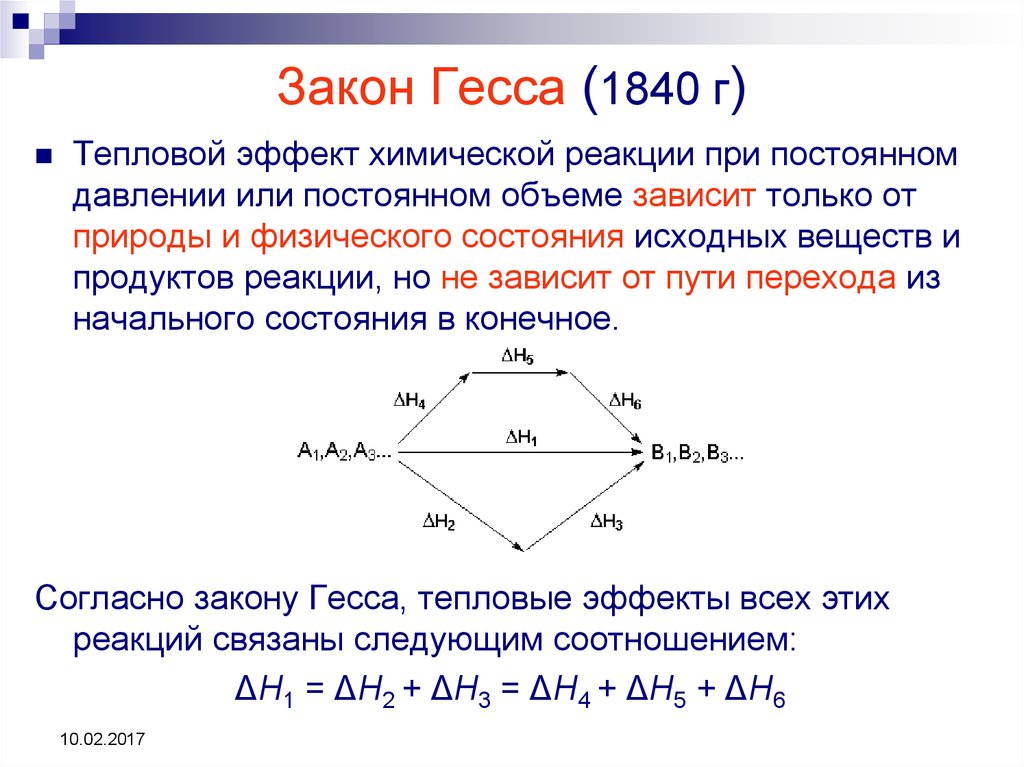 Рассмотрим прототип реакции на подрисунке 2.1, в которой реагенты R превращаются в продукты P. Мы хотим рассчитать тепло, поглощаемое или выделяемое в этой реакции, которое равно ΔH. Поскольку H является функцией состояния, мы можем проследить любой путь от R до P и вычислить ΔH вдоль этого пути. На подрисунке 2.2 мы рассматриваем один такой возможный путь, состоящий из двух реакций, проходящих через промежуточное состояние, содержащее все атомы, участвующие в реакции, каждый в элементной форме. Это полезное промежуточное состояние, поскольку его можно использовать для любой возможной химической реакции. Например, на рисунке 1 в реакцию вовлечены атомы C, H и O, каждый из которых представлен в промежуточном состоянии в виде элемента. На подрисунке 2.2 видно, что ΔH для всей реакции теперь представляет собой разницу между ΔH при образовании продуктов P из элементов и ΔH при образовании реагентов R из элементов.
Рассмотрим прототип реакции на подрисунке 2.1, в которой реагенты R превращаются в продукты P. Мы хотим рассчитать тепло, поглощаемое или выделяемое в этой реакции, которое равно ΔH. Поскольку H является функцией состояния, мы можем проследить любой путь от R до P и вычислить ΔH вдоль этого пути. На подрисунке 2.2 мы рассматриваем один такой возможный путь, состоящий из двух реакций, проходящих через промежуточное состояние, содержащее все атомы, участвующие в реакции, каждый в элементной форме. Это полезное промежуточное состояние, поскольку его можно использовать для любой возможной химической реакции. Например, на рисунке 1 в реакцию вовлечены атомы C, H и O, каждый из которых представлен в промежуточном состоянии в виде элемента. На подрисунке 2.2 видно, что ΔH для всей реакции теперь представляет собой разницу между ΔH при образовании продуктов P из элементов и ΔH при образовании реагентов R из элементов.
Таким образом, значения ΔH для образования каждого материала из элементов имеют общее значение при расчете ΔH для любой интересующей реакции. Поэтому мы определяем стандартную реакцию образования реагента R как
Поэтому мы определяем стандартную реакцию образования реагента R как
элементов в стандартном состоянии R
, а теплота, участвующая в этой реакции, представляет собой стандартную энтальпию образования, обозначаемую ΔH f °. Нижний индекс f, обозначающий «образование», указывает на то, что ΔH относится к реакции создания материала из элементов в стандартном состоянии. Верхний индекс ° указывает на то, что реакции происходят при постоянном стандартном давлении 1 атм. Из подрисунка 2.2 мы видим, что теплоту любой реакции можно вычислить из 9°_{f,reactants}} \tag{6}\]
Были составлены обширные таблицы значений ΔH° f (таблица T1), что позволяет нам с полной уверенностью рассчитать теплоту реакции для любой интересующей реакции. , даже включая гипотетические реакции, которые могут быть трудновыполнимыми или протекать невероятно медленно.
Пример 1
Энтальпия реакции зависит не от элементарных стадий, а от конечного состояния продуктов и начального состояния реагентов. Энтальпия является экстенсивным свойством и, следовательно, изменяется при изменении размера образца. Это означает, что энтальпия реакции увеличивается пропорционально количеству молей, используемых в реакции. Например, в следующей реакции можно видеть, что удвоение молярных количеств просто удваивает энтальпию реакции.
Энтальпия является экстенсивным свойством и, следовательно, изменяется при изменении размера образца. Это означает, что энтальпия реакции увеличивается пропорционально количеству молей, используемых в реакции. Например, в следующей реакции можно видеть, что удвоение молярных количеств просто удваивает энтальпию реакции.
H 2 (г) + 1/2O 2 (г) → H 2 O (г) ΔH° = -572 кДж
2H 2 (г) + O9 2 ( ) → 2H 2 O (г) ΔH° = -1144 кДж
Знак энтальпии реакции изменяется при обращении процесса.
H 2 (г) + 1/2O 2 (г) → H 2 O (г) ΔH° = -572 кДж
При переключении:
H 2 9006 H 2 (г) + 1/2O 2 (г) ΔH° = +572 кДж
Поскольку энтальпия является функцией состояния, она не зависит от пути. Поэтому не имеет значения, какие реакции использовать для получения конечной реакции.
Авторы и ссылки
- Шелли Коэн (UCD)
Закон Гесса распространяется в соответствии с лицензией CC BY-NC-SA 4.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
Закон Гесса | Уравнение, определение и пример
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Компаньоны
- Галереи изображений
- Прожектор
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.

 А. Экологический словарь. — Алма-Ата: Наука, 1983. — 216 с.
А. Экологический словарь. — Алма-Ата: Наука, 1983. — 216 с.
